Todo lo que debe saber sobre las nanopartículas de MoO3
Introducción
El trióxido de molibdeno es uno de los óxidos de metales de transición con la fórmula química MoO3(H2O)n (n=0 a 3). El MoO3 se utiliza en una amplia gama de aplicaciones como fotocatalizadores, óptica, detección de gases, baterías, dispositivos electrónicos, etc. El MoO3 anhidro forma una estructura de octaedros "MoO6" distorsionada. La figura 1 representa su cristal ortorrómbico. Las esferas verdes son de molibdeno y las rojas, de oxígeno. El MoO3 tiene 3 estructuras cristalinas diferentes: las fases α-ortorrómbica, β-monoclínica y h-hexagonal. Las distintas estructuras del MoO3 les confieren propiedades físicas y químicas diferentes. La h-MoO3 muestra estabilidad de fase hasta 436℃, pero la α-MoO3 muestra una transición de fase irreversible por debajo de 436℃ [1].

Figura 1: Estructura de octaedros de MoO6
Cómo se fabrica la nanoestructura de MoO3 y discusión sobre la síntesis por combustión en solución
Hay varias formas sintéticas para preparar nanopartículas de trióxido de molibdeno:
Síntesis hidrotermal: sales de molibdeno como el molibdato de amonio reaccionan con peróxido de hidrógeno en una solución acuosa a alta temperatura y presión para formar nanopartículas de MoO3.
Síntesis solvotérmica: las sales de molibdeno reaccionan con un disolvente orgánico como el etanol a alta temperatura para formar nanopartículas de MoO3.
Co-precipitación: una solución de sales de molibdeno reacciona con un agente de precipitación, como un hidróxido metálico o carbonato, bajo un pH específico y las nanopartículas de MoO3 precipitarán de la solución.
Síntesis por combustión de soluciones: Las sales de molibdeno se mezclan con una mezcla de combustible y oxidante y se queman a alta temperatura para formar nanopartículas de MoO3.
Existen muchas otras formas de síntesis que no se mencionan aquí. Si desea más información o está interesado, póngase en contacto con nosotros en Stanford Advanced Materials. Incluso en una síntesis, diferentes parámetros darán lugar a diferentes tipos de estructuras nano MoO3. Utilicemos como ejemplo la síntesis por combustión de soluciones.
Disolvemos heptamolibdato de amonio (NH4)6Mo7O24-4H2O en agua destilada y mezclamos la solución con un disolvente orgánico (aquí utilizamos Urea, EDTA, PEG 200 y Sorbitol como diferentes aditivos orgánicos para realizar los experimentos). Calentar y agitar la solución hasta que se formen los precipitados. El último paso es calentar los precipitados para eliminar los aditivos orgánicos y otras impurezas [2].
El heptamolibdato de amonio (AHM) es una molécula compleja de gran tamaño que se utiliza a menudo como precursor en la producción de compuestos de Mo. La ecuación química de la síntesis por combustión de la solución de AHM es
El MoO3 puede formarse sin utilizar ningún aditivo, pero los aditivos desempeñan un papel importante a la hora de dirigir el crecimiento de los cristales y los núcleos de MoO3. Utilizamos un microscopio electrónico de barrido (SEM) para detectar las microestructuras producidas mediante el uso de diferentes aditivos orgánicos. Obtenemos las siguientes observaciones La urea produce una morfología más esférica que los otros 3 aditivos. El PEG 200 produce nanopartículas submicro más grandes y menos esféricas. El sorbitol y el EDTA forman nanorods bastante diferentes [2]. Esto se debe a la estructura química de los aditivos orgánicos. La figura 2 muestra las estructuras químicas de estos cuatro aditivos orgánicos. La urea tiene nitrógeno con un par de electrones no enlazantes. El PEG200 y el sorbitol tienen oxígeno en el grupo OH. El EDTA tiene ambos nitrógenos con un par de electrones no enlazantes y oxígeno en el grupo OH. En la formación del ligando, el nitrógeno con 2 electrones libres es más que el oxígeno. Así que la urea es más fácil de atraer el Mo del AHM para formar núcleos con un tamaño más pequeño en comparación con el PEG200 y el sorbitol [2].
El EDTA tiene 2 nitrógenos con 2 electrones libres y 4 oxígenos en OH. A primera vista, puede ser el aditivo más adecuado para fabricar nanopartículas de MoO3. Pero el EDTA es un compuesto complejo muy grande como se ha mencionado anteriormente. El efecto estérico impide que el nitrógeno del EDTA atraiga al Mo. Sólo el grupo de oxígeno interviene en la estructura del ligando y crea microestructuras de MoO3 [2].
El PEG200 sólo tiene grupo oxígeno en los dos lados. No es tan atractivo como la urea, lo que significa que tiene una baja posibilidad de formar MoO3 simultáneamente en ambos lados. Pero el PEG200 es un compuesto de estructura muy simple con un bajo efecto de impedimento estérico. Es más fácil para el PEG 200 hacer la formación del ligando que para el EDTA [2].
Cuando uno de los grupos de oxígeno del sorbitol se une al Mo, es imposible que su otro grupo de oxígeno se una a otro Mo debido a su estructura lineal. En definitiva, el sorbitol no es un buen aditivo para fabricar nanopartículas de MoO3 [2]. Otras condiciones como el pH, la temperatura de reacción, la concentración de Mo y la relación Mo/aditivo también pueden afectar a las propiedades de las nanopartículas de MoO3 producidas.
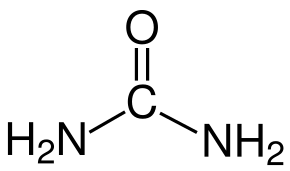
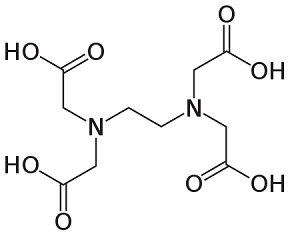
Urea EDTA
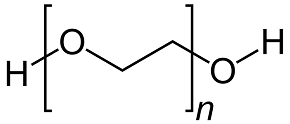
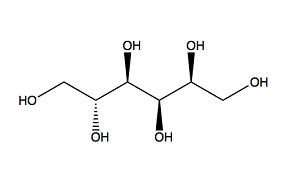
PEG200 Sorbitol
Figura 2: estructuras moleculares de los aditivos orgánicos utilizados en el experimento
Aplicaciones del MoO3
La membrana de MoO3 tiene buenas propiedades electrocrómicas. En comparación con otros materiales como el WO3 y el TiO2, el MoO3 tiene un tiempo de respuesta más corto. Además, el MoO3 cambia a gris cuando detecta un estímulo eléctrico. Su curva de absorción es suave en la región visible. El pico de absorción se encuentra cerca de 550 nm, que está cerca de la banda sensible del ojo humano. La fabricación de MoO3 supremo mediante nanopartículas de MoO3 es una de las investigaciones más populares.
El PVC es un material polimérico termoplástico muy utilizado, pero produce un denso humo al arder. El metal de transición muestra una buena supresión del humo. Combinando 2 o más tipos de compuestos de metales de transición, se puede restringir seriamente el denso humo del PVC. El PVC presenta graves riesgos de incendio debido a la adición de plastificantes. El MoO3 también muestra una buena retardación de la llama. Combinando MoO3 con Cu2O, muestran un efecto sinérgico que puede reducir el coste del aditivo MoO3 puro y mantener las buenas propiedades de los cables.
El MoO3 es un fotocatalizador muy eficaz. A diferencia del tratamiento tradicional de tintes de aguas residuales, los nanofotocatalizadores pueden convertir los contaminantes en productos inocuos, como el CO2 [3]. Las nanopartículas confieren al MoO3 una mayor superficie de contacto para lograr una velocidad de degradación más rápida.
El MoO3 es un semiconductor de tipo n que puede utilizarse en amplias aplicaciones, como la detección de gases. Los detectores de gas de óxido metálico "transfieren" el gas en electricidad, lo que resulta más rápido y sencillo que otros detectores. A diferencia de otros detectores de gas de óxido metálico, el MoO3 es un material semiconductor de banda prohibida ancha con sitios activos en su superficie que reaccionan selectivamente con el gas a medir. El MoO3 tiene características de alta sensibilidad a los gases. Muestra sensibilidad a NH3, H2, CO y otros gases a unos 450℃. La membrana de MoO3 puro no funciona bien debido a su alta sensibilidad a la temperatura y a la selectividad. Combinándolo con otros materiales para mejorar la capacidad de MoO3 sensible a los gases. Por ejemplo, la combinación de MoO3 con V2O5 para hacer membranas muestran una alta sensibilidad a baja temperatura (alrededor de 150℃) a NO2, NH3, CO, CH4, SO2 y H2.
Hay muchas aplicaciones para las nanopartículas de MoO3 que no se han mencionado. Stanford Advanced Materials (SAM) ofrece diferentes tipos de MoO3. Si desea más información sobre el MoO3, puede proporcionar la información de su aplicación a nuestro personal técnico para que le asesore.
Referencia
- Pannipa Wongkrua, Titipun Thongtem, Somchai Thongtem, "Synthesis of h- and α-MoO3 by Refluxing and Calcination Combination: Phase and Morphology Transformation, Photocatalysis, and Photosensitization", Journal of Nanomaterials, vol. 2013, Article ID 702679, 8 pages, 2013. https://doi.org/10.1155/2013/702679
- Parviz, D., Kaz→emeini, M., Rashidi, A. M., & Jafari Jozani, K. (2009). Synthesis and characterization of MOO3 nanostructures by solution combustion method employing morphology and size control. Journal of Nanoparticle Research, 12(4), 1509-1521. https://doi.org/10.1007/s11051-009-9727-6
- Thekkethil, A. J., Sreekuttan, S., & Madhavan, A. A. (2021). Application of nano molybdenum trioxide in thermal storage and photocatalysis. Journal of Physics: Conference Series, 2070(1), 012120. https://doi.org/10.1088/1742-6596/2070/1/012120

 Bares
Bares
 Cuentas y esferas
Cuentas y esferas
 Tornillos y tuercas
Tornillos y tuercas
 Crisoles
Crisoles
 Discos
Discos
 Fibras y tejidos
Fibras y tejidos
 Películas
Películas
 Escama
Escama
 Espumas
Espumas
 Folio
Folio
 Gránulos
Gránulos
 Panales
Panales
 Tinta
Tinta
 Laminado
Laminado
 Bultos
Bultos
 Mallas
Mallas
 Película metalizada
Película metalizada
 Placa
Placa
 Polvos
Polvos
 Varilla
Varilla
 Hojas
Hojas
 Cristales individuales
Cristales individuales
 Blanco para sputtering
Blanco para sputtering
 Tubos
Tubos
 Lavadora
Lavadora
 Cables
Cables
 Conversores y calculadoras
Conversores y calculadoras
 Chin Trento
Chin Trento



