Envenenamiento de catalizadores de metales preciosos: Causas, problemas y soluciones
1 Introducción
Los catalizadores de metales preciosos desempeñan un papel importante en la industria química, el sector energético y la protección del medio ambiente. Gracias a su estructura electrónica única y a sus propiedades superficiales, los catalizadores de metales preciosos pueden catalizar eficazmente diversas reacciones químicas. Sin embargo, en la práctica, los tóxicos suelen afectar a estos catalizadores, lo que se traduce en una menor actividad, una selectividad alterada e incluso una vida útil más corta. Para hacer frente a este reto, en este blog se analizarán en detalle los mecanismos y aplicaciones de los catalizadores de metales preciosos, se examinarán las causas y efectos del envenenamiento de los catalizadores y se propondrán medidas para mejorar su capacidad antienvenenamiento y su vida útil.

Fig. 1 Polvo negro de platino (para pilas de combustible) suministrado por Stanford Advanced Materials
2 Introducción a los catalizadores de metales preciosos
2.1 Mecanismos de los catalizadores de metales preciosos
En términos de estructura electrónica, los metales nobles (por ejemplo, platino, paladio, rodio, iridio, etc.) tienen orbitales de electrones d llenos o casi llenos. Estos orbitales de electrones d pueden solaparse eficazmente con los orbitales de las moléculas reactivas, proporcionando así la energía de activación necesaria para que la reacción pueda llevarse a cabo con una barrera energética más baja. La participación de electrones d permite a los metales nobles formar intermedios con una amplia gama de reactivos (por ejemplo, hidrógeno, oxígeno, hidrocarburos, etc.) y facilitar el proceso de reacción. La alta densidad de electrones y la uniformidad de distribución de los átomos de metales preciosos proporcionan una alta densidad de nubes de electrones en sus superficies. Esto ayuda al catalizador de metal noble a proporcionar o aceptar electrones en la reacción, desempeñando el papel de un buen donante o aceptor de electrones y favoreciendo la reacción.
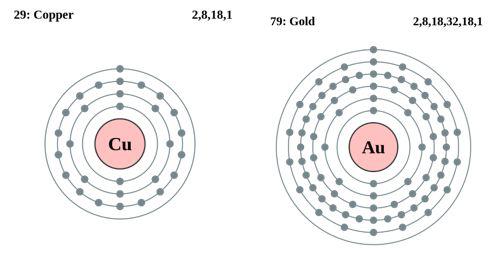
Fig. 2 Disposición periférica de los electrones de los átomos de cobre y oro
Desde la perspectiva de las propiedades superficiales, la superficie del metal precioso tiene una fuerte capacidad de adsorción, que puede adsorber eficazmente moléculas reactivas. Esta capacidad de adsorción procede principalmente de la fuerte interacción entre los átomos de metales preciosos y la alta actividad de los átomos superficiales. Los catalizadores de metales preciosos pueden interactuar con las moléculas reactivas mediante adsorción física y química, proporcionando sitios activos para promover la reacción. Las superficies de los catalizadores de metales preciosos también tienen una buena capacidad de reconstrucción. Durante el proceso de reacción, la superficie de los átomos de metales preciosos puede sufrir cierto grado de reconstrucción para adaptarse a la adsorción y reacción de diferentes moléculas reactivas. Esta capacidad de remodelación de la superficie ayuda al catalizador a mantener una actividad catalítica eficaz en diferentes condiciones de reacción.
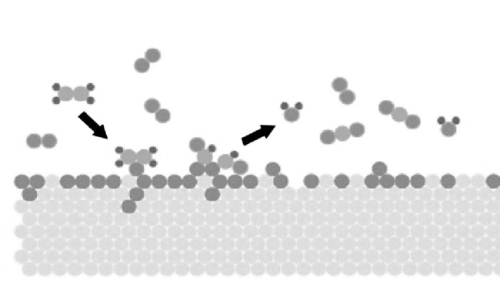
Fig. 3 Diagrama esquemático de la reacción de moléculas de gas adsorbidas en la superficie de metales preciosos
Además, los metales preciosos tienen una gran estabilidad termodinámica y pueden mantener su estructura y actividad catalítica a altas temperaturas y en entornos químicos agresivos. Esto permite que los catalizadores de metales preciosos presenten una excelente durabilidad y estabilidad en una amplia gama de reacciones industriales (por ejemplo, craqueo a alta temperatura, reacciones de oxidación, etc.).
Los catalizadores de metales preciosos son capaces de catalizar muchos tipos de reacciones, como la hidrogenación, la oxidación, la desproporción, el acoplamiento, etcétera. Esta versatilidad se debe principalmente a sus abundantes sitios tensioactivos y a sus estructuras electrónicas flexibles, que permiten a los metales preciosos adaptarse a diferentes mecanismos y condiciones de reacción. Los distintos tipos de metales preciosos también pueden formar aleaciones con otros metales para regular aún más sus estructuras electrónicas y propiedades superficiales. Por ejemplo, los catalizadores de aleación de platino y paladio presentan un rendimiento catalítico superior al de los metales individuales en determinadas reacciones. La aleación puede optimizar la actividad, selectividad y estabilidad de los catalizadores de metales preciosos, mejorando así su rendimiento global.
2.2 Aplicaciones de los catalizadores de metales preciosos
Los catalizadores de metales preciosos se utilizan en el tratamiento de gases para proteger el medio ambiente debido a su efecto catalizador en las reacciones gaseosas. Los catalizadores ternarios utilizados habitualmente en el tratamiento de los gases de escape de los automóviles utilizan platino (Pt), paladio (Pd) y rodio (Rh) como componentes principales para convertir el monóxido de carbono (CO), los óxidos de nitrógeno (NOx) y los hidrocarburos no quemados (HC) de los gases de escape de los automóviles en dióxido de carbono (CO2), nitrógeno (N2) y agua (H2O) inocuos. El platino y el paladio también se utilizan en los sistemas de tratamiento de gases de escape de motores diesel para oxidar las partículas de carbono y los óxidos de nitrógeno emitidos por los motores diesel. El tratamiento de gases de escape en plantas químicas industriales y refinerías también utiliza catalizadores de metales preciosos como el platino y el paladio para el tratamiento, que pueden eliminar eficazmente los componentes nocivos de los gases de escape. Los sensores químicos basados en catalizadores de metales preciosos se utilizan para detectar contaminantes gaseosos, gases tóxicos y biomoléculas en el medio ambiente, por ejemplo, sensores de hidrógeno y sensores de formaldehído. Los catalizadores de metales preciosos también se utilizan para la degradación de contaminantes, como la degradación fotocatalítica de contaminantes orgánicos en el tratamiento del agua, y los catalizadores compuestos de platino y óxidos de titanio en la hidrólisis fotocatalítica del agua para la producción de hidrógeno.
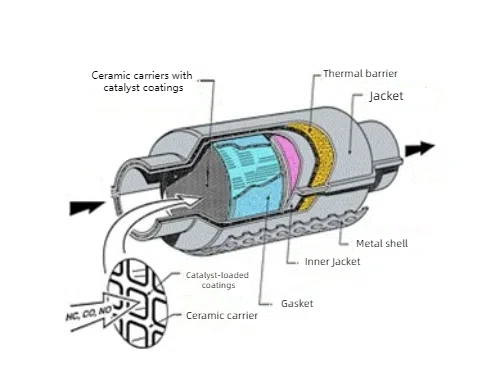
Fig. 4 Estructura del catalizador de tres vías
En el campo de la energía, los catalizadores de metales preciosos, especialmente los catalizadores de platino, se utilizan en el proceso electroquímico de la electrólisis del agua y la oxidación de las pilas de combustible de metanol para mejorar la eficiencia de la conversión de la energía eléctrica. Los catalizadores de platino de las pilas de combustible de membrana de intercambio protónico (PEMFC ) promueven la reacción electroquímica entre el hidrógeno y el oxígeno en los electrodos para generar electricidad y agua. Los catalizadores de aleación de platino y rutenio de las pilas de combustible de metanol directo (DMFC ) se utilizan para oxidar el metanol y mejorar la eficiencia de las pilas de combustible. Los electrodos de platino también pueden utilizarse para electrolizar agua y producir hidrógeno, mejorando la eficacia de la reacción. Los catalizadores de metales preciosos también se utilizan en la conversión de biomasa para transformar materias primas de biomasa en productos químicos y combustibles de alto valor añadido, como la reacción de hidrodesoxigenación en la producción de biodiésel.
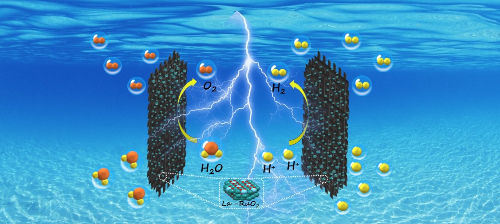
Fig. 5 Producción de hidrógeno a partir de agua electrolítica ácida catalizada por La-RuO2 [5]
En la producción química, los catalizadores de metales preciosos se utilizan ampliamente en aplicaciones relacionadas con la química orgánica. En la industria del refinado del petróleo, tanto los catalizadores de platino como los de paladio pueden utilizarse en el proceso de hidrodesulfuración para eliminar los sulfuros del petróleo crudo, lo que puede mejorar la calidad del combustible. En el proceso de reformado del petróleo, los catalizadores de platino también ayudan a producir gasolina de alto octanaje y compuestos aromáticos. En la industria de síntesis orgánica, los catalizadores de platino y paladio se utilizan ampliamente para catalizar reacciones de hidrogenación, mejorando significativamente la eficacia del proceso de hidrogenación de dobles y triples enlaces de diversos compuestos orgánicos. Los catalizadores de paladio también pueden catalizar la reacción de acoplamiento de Suzuki y la reacción de Heck, que desempeñan un papel importante en la síntesis de fármacos y la construcción de moléculas orgánicas complejas. En el campo de la síntesis de fármacos, los catalizadores de metales preciosos se utilizan a menudo para transformaciones químicas en etapas clave, como las reacciones de acoplamiento cruzado catalizadas por paladio, que desempeñan un papel insustituible en la síntesis de moléculas complejas de fármacos. Los catalizadores de platino y paladio también se utilizan habitualmente en catálisis quiral, catalizando procesos de reacción de hidrogenación asimétrica para producir intermedios farmacológicos quirales, garantizando la pureza óptica y la actividad biológica de los fármacos. Los catalizadores de metales preciosos tienen importantes aplicaciones en la preparación de nanomateriales, como el uso de catalizadores de platino y oro para preparar nanomateriales de alto rendimiento para su uso en dispositivos electrónicos y optoelectrónicos.
3 Envenenamiento de catalizadores
3.1 Definición de intoxicación catalítica
El envenenamiento de catalizadores se refiere a la pérdida o reducción significativa de la actividad catalítica de un catalizador durante una reacción química debido a la presencia de ciertas sustancias (conocidas como venenos o sustancias venenosas). Estos venenos se quimisorben fuertemente o reaccionan con los sitios activos del catalizador, impidiendo así que el catalizador entre en contacto y reaccione normalmente con los reactivos. El envenenamiento del catalizador es un fenómeno desfavorable que conduce a una reducción de la eficacia de la reacción química o incluso a su cese completo.
3.2 Causas y tipos de envenenamiento del catalizador
Existen tres mecanismos principales de envenenamiento de catalizadores.
1. Adsorción química: Fuerte adsorción química de moléculas de veneno con los sitios activos del catalizador, de forma que estos sitios no pueden seguir reaccionando con los reactivos.
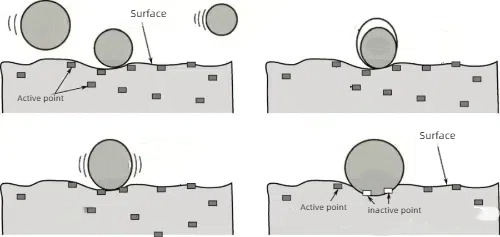
Fig. 6 Principio esquemático de la quimisorción
2. Reacción química: El tóxico reacciona con los componentes activos del catalizador para producir compuestos inactivos que cubren la superficie del catalizador.
3. Bloqueofísico: Ciertos tóxicos forman depósitos en la superficie del catalizador, bloqueando físicamente los poros o sitios activos del catalizador.
La desactivación causada por el envenenamiento del catalizador es diferente debido a diferentes causas y grados.
1. Envenenamiento temporal (envenenamiento reversible): Cuando el veneno se adsorbe o se combina químicamente en el centro activo, la fuerza de enlace generada es relativamente débil, y se pueden tomar métodos apropiados para eliminar el veneno, de modo que la actividad del catalizador se puede restaurar sin afectar la naturaleza del catalizador, y este tipo de envenenamiento se llama envenenamiento reversible o envenenamiento temporal.
2. Envenenamiento permanente (envenenamiento irreversible): El veneno interactúa con los componentes activos del catalizador para formar un enlace químico muy fuerte, y es difícil eliminar el veneno de forma general para restaurar la actividad del catalizador, este tipo de envenenamiento se denomina envenenamiento irreversible o envenenamiento permanente.
3. Envenenamientoselectivo: Después del envenenamiento, el catalizador puede perder la capacidad catalítica para una determinada reacción, pero seguir teniendo actividad catalítica para otras reacciones, este fenómeno se denomina envenenamiento selectivo. En una serie de reacciones, si el veneno sólo causa el envenenamiento del sitio activo de la reacción subsiguiente, la reacción puede permanecer en la etapa intermedia y obtener un alto rendimiento de productos intermedios.
4 Problemas causados por el envenenamiento del catalizador
4.1 Reducción de la actividad del catalizador
1. 1.Ocupación de los sitios activos: Las toxinas se quimisorben fuertemente o reaccionan con los sitios activos de la superficie del catalizador, haciendo que estos sitios sean ocupados por la toxina e impidiendo la adsorción y reacción de las moléculas reactivas, lo que resulta en una reducción significativa de la actividad del catalizador. Por ejemplo, los sulfuros (por ejemplo, H2S) reaccionan con la superficie de los catalizadores de platino o paladio para formar sulfuro de platino o sulfuro de paladio, inutilizando así estos sitios activos.
2. Cobertura dela superficie: Las toxinas forman una capa de recubrimiento en la superficie del catalizador que impide físicamente que los reactivos alcancen los sitios activos del catalizador. Este efecto de recubrimiento también reduce en gran medida la superficie efectiva del catalizador y disminuye su actividad. Por ejemplo, los fosfatos forman una capa de recubrimiento en la superficie de algunos catalizadores que impide la adsorción de los reactivos.
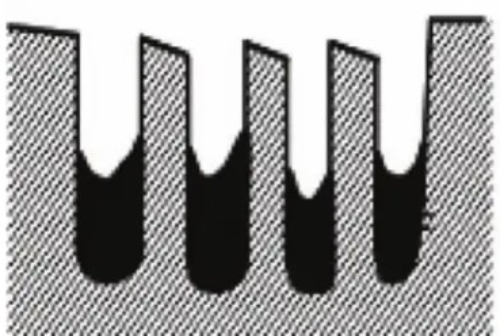
Fig. 7 Estructura del catalizador pasivado tras el recubrimiento superficial
4.2 Cambios selectivos
1. Ocupación específica de los sitios activos
Ciertos tóxicos se unen selectivamente a sitios activos específicos, lo que resulta en la modificación de la actividad y función de estos sitios. Por ejemplo, ciertas reacciones pueden depender de tipos específicos de sitios activos (por ejemplo, sitios localizados en ciertos planos cristalinos o en disposiciones atómicas específicas), y la adsorción de tóxicos ocupará preferentemente estos sitios, alterando así la selectividad global del catalizador.
Por ejemplo, en la hidrogenación selectiva del etileno, los catalizadores de Pd presentan una alta selectividad, pero si la superficie del catalizador está envenenada por azufre (S), los átomos de azufre se adsorberán preferentemente a los sitios activos de la superficie de Pd, alterando las propiedades superficiales del catalizador y dando lugar a una reacción más inclinada a producir etano no deseado en lugar de etileno.
2. Alteración de la ruta de reacción
La presencia de un tóxico puede alterar la ruta de una reacción catalizada, aunque no ocupe totalmente el sitio activo, al cambiar las propiedades electrónicas o geométricas de la superficie del catalizador, dificultando la formación de ciertos intermedios o estados de transición o haciendo más probable su descomposición, lo que da lugar a que la reacción se oriente hacia un producto diferente.
Un ejemplo típico es el cambio en la densidad de electrones en la superficie de un catalizador de rodio (Rh) tras el envenenamiento del catalizador por fósforo (P) en la reacción de hidroformilación del propileno, lo que da lugar a un desplazamiento del principal producto generado del n-butiraldehído al isobutiraldehído, un cambio en la selectividad que se debe al diferente efecto estabilizador del fósforo sobre los productos intermedios de la reacción.
3. Remodelación de la superficie y cambios geométricos
La adsorción de tóxicos en la superficie del catalizador puede causar la reordenación o remodelación de átomos o moléculas en la superficie del catalizador, cambiando la geometría de la superficie del catalizador y afectando así a la adsorción y a las rutas de reacción de las moléculas reactivas. Estos cambios geométricos pueden provocar una disminución o una pérdida completa de selectividad para determinadas reacciones específicas.
En la reacción de síntesis Fischer-Tropsch, los catalizadores de hierro (Fe) se utilizan para la síntesis de hidrocarburos de cadena larga. Sin embargo, cuando la superficie del catalizador de Fe se envenena con azufre, los átomos de azufre provocan una remodelación de la superficie que disminuye la generación de hidrocarburos de cadena larga y aumenta la generación de metano e hidrocarburos de cadena corta. Este cambio de selectividad se debe al cambio en la estructura geométrica de los sitios activos de la superficie.
Fig. 8 Principio esquemático del proceso Fischer-Tropsch
4. Cambios en la estabilidad de los intermedios
La presencia de tóxicos puede alterar la estabilidad de los productos intermedios de la reacción en la superficie del catalizador, lo que facilita la desorción o dificulta la generación de determinados productos intermedios, limitando así la distribución del producto final de la respuesta.
En la reacción de oxidación del propileno, el catalizador de molibdeno (Mo) se utiliza para generar acroleína, pero si el catalizador se envenena con cloro (Cl), el cloro altera la estabilidad de los productos intermedios de reacción (por ejemplo, óxido de propileno), lo que provoca una disminución de la selectividad de la generación de acroleína y un aumento de la generación de productos de oxidación incompletos, como el dióxido de carbono.
5. Efecto electrónico
La adsorción de tóxicos cambia el entorno electrónico en la superficie del catalizador, lo que afecta a la energía de adsorción y a las barreras energéticas de reacción de los reactivos. Especialmente cuando el tóxico es fuertemente electronegativo o puede formar una diferencia de densidad electrónica con la superficie del metal, este efecto electrónico puede cambiar significativamente la selectividad de reacción del catalizador.
En la reacción de oxidación parcial del metanol, se utilizan catalizadores de oro (Au) para generar formaldehído, pero cuando hay oxígeno (O2) u óxidos (p. ej., alúmina) presentes, los átomos de oxígeno adsorbidos cambian la densidad electrónica en la superficie de los catalizadores de oro, lo que conduce a una mayor oxidación del formaldehído a ácido fórmico o incluso a dióxido de carbono, lo que reduce la selectividad del formaldehído.
4.3 Reducción de la vida útil del catalizador
Los fenómenos de intoxicación son a menudo irreversibles, especialmente cuando el tóxico reacciona fuertemente con el catalizador para producir un compuesto estable. Esta desactivación irreversible significa que el catalizador no puede recuperar su actividad tras un largo periodo mediante tratamientos sencillos (por ejemplo, regeneración), lo que acorta significativamente la vida útil del catalizador.
Además, la acción de los venenos puede provocar cambios en la estructura superficial del catalizador, o incluso causar la aglomeración o sinterización de las partículas del catalizador, lo que reduce aún más la estabilidad y la vida útil del catalizador.
4.4 Aumento de los costes del proceso
Como el fenómeno de la toxicación conduce a una reducción de la actividad y la vida útil del catalizador, el proceso requiere una sustitución o regeneración más frecuente del catalizador, lo que aumenta los costes de producción. Además, pueden ser necesarios complejos pretratamientos de la materia prima, como la desulfuración y la desfosforación, antes de la reacción para reducir los efectos de la intoxicación, lo que aumenta aún más los costes de explotación y la inversión en equipos.
5 Medidas para hacer frente a la intoxicación de catalizadores
5.1 Modificación del catalizador
1. 1. Aleación: La aleación es la formación de catalizadores aleados con propiedades mejoradas mediante la combinación de metales preciosos con otros metales. Este método es eficaz para mejorar la resistencia del catalizador a la toxicidad. Por ejemplo, el paladio (Pd) se alea con otros metales como el oro (Au) o la plata (Ag) para mejorar su resistencia a los compuestos de azufre y nitrógeno.
Los sulfuros son uno de los venenos habituales de los catalizadores, sobre todo en el refinado del petróleo y los procesos químicos. Mediante la aleación de paladio (Pd) con oro (Au) o plata (Ag), se puede mejorar significativamente la resistencia de un catalizador a los sulfuros. Por ejemplo, los catalizadores aleados con paladio y oro ofrecen una mayor resistencia al envenenamiento por sulfuros en comparación con los catalizadores de paladio puro, ya que la presencia de oro altera la estructura electrónica de la superficie del catalizador y reduce la adsorción de azufre, disminuyendo así la velocidad de envenenamiento.
Los nitruros son también una de las principales fuentes de envenenamiento de catalizadores, especialmente en las reacciones de síntesis de amoníaco y desnitrificación. Mediante la aleación del paladio con otros metales, como el cobre Cu o el platino Pt, se puede mejorar la tolerancia del catalizador a los nitruros. La aleación puede ajustar la densidad de electrones y la geometría de la superficie del catalizador, reducir la fuerza de adsorción de los nitruros y retrasar la desactivación del catalizador.
2. Modificación dela superficie: Modificación de la superficie del catalizador, como la adición de una capa de óxido o carbono a la superficie del catalizador de metal noble, para evitar que los venenos entren en contacto directo con los sitios activos. Por ejemplo, recubrimiento de óxido y modificación de la capa de carbono.
Laadición de un recubrimiento de óxido, como óxido de aluminio (Al2O3) o dióxido de silicio (SiO2), a la superficie de un catalizador de metal noble puede mejorar la resistencia del catalizador a la toxicidad. Por ejemplo, un revestimiento de alúmina en la superficie de un catalizador de paladio puede bloquear eficazmente el contacto de los sulfuros con los sitios activos de la superficie de paladio, mejorando así la resistencia a los sulfuros del catalizador de paladio. Además, el recubrimiento de óxido puede proporcionar sitios ácidos o básicos adicionales, mejorando aún más la selectividad y la actividad del catalizador.
La adición de una capa de carbono a la superficie de un catalizador de metal precioso es también un método eficaz de modificación de la superficie. La capa de carbono puede evitar el contacto directo de los tóxicos con los sitios activos del catalizador mediante adsorción y apantallamiento. Por ejemplo, depositando una capa de grafeno o carbono activado en la superficie de un catalizador de paladio, se puede mejorar su tolerancia a los sulfuros y nitruros, manteniendo al mismo tiempo una buena actividad catalítica. La modificación de la capa de carbono no sólo mejora la resistencia del catalizador a la toxicidad, sino que también aumenta su estabilidad térmica y su resistencia mecánica.
5.2 Pretratamiento de las materias primas
El pretratamiento de las materias primas es un paso clave para evitar el envenenamiento de los catalizadores de metales preciosos. Mediante un tratamiento eficaz de desulfuración, desfosforación y desnitrogenación, se puede reducir significativamente el efecto del veneno sobre el catalizador, prolongar su vida útil y mantener su rendimiento catalítico eficiente.
1. 1.Desulfuración: La desulfuración se refiere a la eliminación de sulfuros de la materia prima antes de la reacción para evitar el envenenamiento del catalizador por sulfuros. Los sulfuros son uno de los venenos comunes de los catalizadores, especialmente en el refinado del petróleo y en la producción química, donde reaccionan con los sitios activos de la superficie del catalizador, provocando su desactivación. La hidrodesulfuración es una tecnología de desulfuración común que elimina el sulfuro de hidrógeno de la materia prima mediante la reacción con el sulfuro a alta temperatura y alta presión utilizando gas hidrogenado que contiene hidrógeno para convertir el sulfuro en sulfuro de hidrógeno (H₂S). Este método elimina eficazmente compuestos organoazufrados como mercaptanos, tioéteres y tioésteres de la materia prima, reduciendo así el efecto tóxico de estos sulfuros en el catalizador.
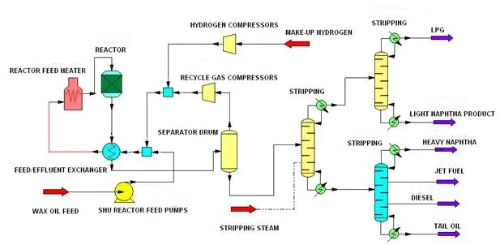
Fig. 9 Proceso de hidrodesulfuración
2. Desfosforización: el fosfuro es también una de las principales fuentes de envenenamiento del catalizador, especialmente en determinadas reacciones catalíticas, el fosfuro reaccionará con la superficie del catalizador, provocando el fallo del sitio activo. Por lo tanto, es muy necesario utilizar el agente desfosforante para desfosforizar la materia prima. Un agente desfosforante es un reactivo químico diseñado específicamente para eliminar el fosfuro de la materia prima. El agente desfosforante reacciona con los fosfuros de la materia prima para formar un precipitado sólido que es insoluble en la materia prima y así eliminarlos. Por ejemplo, en algunos procesos industriales, los agentes desfosforantes a base de calcio pueden utilizarse para reaccionar con los fosfatos y formar precipitados de fosfato de calcio, logrando así el propósito de la desfosforización.
3. 3.Desnitrificación: Los compuestos que contienen nitrógeno son también una de las causas importantes de envenenamiento de catalizadores, especialmente en reacciones petroquímicas y de síntesis orgánica, en las que los compuestos de nitrógeno se combinarán con los sitios activos del catalizador, provocando su desactivación. Para evitarlo, es necesario desnitrificar la materia prima. Los compuestos que contienen nitrógeno son también una de las causas importantes del envenenamiento de los catalizadores, especialmente en las reacciones de síntesis petroquímica y orgánica, donde los nitruros se combinarán con los sitios activos del catalizador, provocando su desactivación. Para evitar esta situación, es necesario desnitrificar las materias primas.
5.3 Optimización de las condiciones de reacción
1. Control de la temperatura de reacción: la temperatura de reacción influye directamente en la actividad y estabilidad del catalizador. El comportamiento de adsorción y desorción de reactivos e intermedios, así como la tasa de generación de venenos, cambiarán bajo diferentes condiciones de temperatura. Optimizando la temperatura de reacción, se puede reducir la generación y adsorción de tóxicos. Realizar la reacción a temperaturas más bajas reduce la generación de determinados subproductos tóxicos. Muchos tóxicos (por ejemplo, sulfuros, fosfuros) se forman más fácilmente a temperaturas más altas, y reducir la temperatura de reacción puede inhibir la formación de estos subproductos. Por ejemplo, en el proceso de hidrodesulfuración (HDS), la producción de sulfuro de hidrógeno (H₂S)puede reducirse bajando la temperatura de reacción, lo que protege al catalizador del envenenamiento por sulfuro. Las bajas temperaturas ayudan a reducir la adsorción de venenos en la superficie del catalizador. Las altas temperaturas aumentan la energía cinética de los reactivos y los venenos, lo que facilita que se adsorban fuertemente con los sitios activos de la superficie del catalizador, lo que puede provocar su envenenamiento. Controlando la temperatura de reacción se puede reducir la adsorción de venenos y prolongar el ciclo activo del catalizador.
2. En la reacción de hidrogenación, la presión de hidrógeno es un parámetro clave que afecta directamente a la velocidad de reacción y a la selectividad del catalizador. Mediante la optimización de la presión de hidrógeno, la hidrogenación excesiva y la formación de venenos pueden reducirse eficazmente, protegiendo así el catalizador de metales preciosos de la intoxicación. En las reacciones de hidrogenación, una presión de hidrógeno demasiado alta puede dar lugar a una hidrogenación excesiva de los reactivos y a la generación de productos totalmente hidrogenados no deseados. Por ejemplo, en una reacción de hidrogenación parcial de alquinos, una presión de hidrógeno demasiado alta puede dar lugar a una hidrogenación excesiva de los alquinos a alcanos en lugar del producto objetivo olefinas. Controlando la presión de hidrógeno, puede regularse con precisión el grado de hidrogenación de los reactivos para evitar la sobrehidrogenación, mejorando así la selectividad de la reacción y protegiendo la actividad del catalizador. La presión de hidrógeno también afecta a la generación de venenos. En algunas reacciones, una presión de hidrógeno excesiva puede favorecer la aparición de reacciones secundarias y la generación de subproductos tóxicos. Por ejemplo, en la oxidación parcial del metano, una presión de hidrógeno excesiva puede dar lugar a una mayor oxidación del formaldehído a ácido fórmico o dióxido de carbono, aumentando así la toxicidad de los venenos para el catalizador. Optimizando la presión de hidrógeno, se puede inhibir la aparición de estas reacciones secundarias, reducir la formación de venenos y proteger la actividad del catalizador.
5.4 Regeneración del catalizador
La regeneración del catalizador es una parte importante del proceso para evitar el envenenamiento de los catalizadores de metales preciosos. Los catalizadores se contaminarán inevitablemente con venenos durante su uso, lo que provocará una disminución de la actividad catalítica. Mediante técnicas de regeneración adecuadas, se pueden eliminar los venenos de la superficie del catalizador y restaurar su rendimiento catalítico.

Fig. 10 Comparación del aspecto de varios catalizadores antes y después de la regeneración
1. Regeneración química: Eliminación de venenos en la superficie del catalizador mediante métodos químicos, como el tratamiento de oxidación o reducción. Este método suele incluir un tratamiento oxidante y un tratamiento reductor.
El tratamiento de oxidación elimina los tóxicos en la superficie del catalizador introduciendo oxígeno u otros agentes oxidantes para oxidar y descomponer los tóxicos orgánicos u otras sustancias oxidables en la superficie del catalizador. Por ejemplo, en el caso de un catalizador contaminado con hidrocarburos, se puede introducir aire u oxígeno a alta temperatura para oxidar los hidrocarburos de la superficie y convertirlos en dióxido de carbono y agua, eliminando así los tóxicos.
Los tratamientos de reducción se realizan en catalizadores contaminados con venenos reductores mediante la introducción de un agente reductor, como el hidrógeno, para restaurar su actividad. Por ejemplo, un catalizador de paladio envenenado por sulfuro puede tratarse con un tratamiento de reducción bajo una atmósfera de hidrógeno para convertir el sulfuro de paladio de la superficie en paladio metálico y gas sulfuro de hidrógeno, eliminando así el veneno y restaurando la actividad del catalizador.
2. Tratamiento térmico Regeneración: Eliminar los venenos orgánicos o los depósitos de coque en la superficie del catalizador mediante tostado a alta temperatura para restaurar la actividad del catalizador. Este método incluye el tostado y el tratamiento por pirólisis.
El tostado a alta temperatura consiste en tratar el catalizador a altas temperaturas para eliminar los venenos orgánicos o los depósitos de carbono en la superficie mediante descomposición térmica o combustión. Por ejemplo, en el caso de un catalizador envenenado por depósitos de coque, el catalizador puede tratarse mediante tostado a alta temperatura para quemar el coque de la superficie, eliminando así los venenos y restaurando la actividad del catalizador. La temperatura y el tiempo de tostado deben optimizarse en función de la naturaleza del catalizador y del tipo de veneno para garantizar la eliminación efectiva del veneno sin dañar la estructura del catalizador.
El tratamiento por pirólisis elimina los venenos descomponiendo los venenos orgánicos de la superficie del catalizador en productos volátiles a altas temperaturas. Por ejemplo, para catalizadores envenenados por organofosfatos, se puede realizar un tratamiento de pirólisis a altas temperaturas para descomponer los fosfuros en productos gaseosos, eliminando así los venenos y restaurando la actividad del catalizador.
5.5 Utilización de inhibidores selectivos de la toxicidad
La adición de co-catalizadores al sistema de reacción también puede ser eficaz para proteger los catalizadores de metales preciosos. Por ejemplo, la adición de pequeñas cantidades de óxidos metálicos puede adsorber o convertir tóxicos, protegiendo así la actividad del catalizador. En los sistemas catalizadores de paladio, la adición de pequeñas cantidades de óxidos de lantano (La) o cerio (Ce) puede mejorar significativamente la resistencia al azufre del catalizador. Estos óxidos metálicos reaccionan con los tóxicos y evitan que se unan al catalizador de metal precioso, alargando así la vida del catalizador y manteniendo su eficacia.
5.6 Diseños avanzados de catalizadores
1. 1. CatalizadoresCore-Shell: Los catalizadores Core-Shell son un diseño de catalizador en el que el núcleo de metal activo está encapsulado dentro de una capa de revestimiento estable. Un catalizador core-shell consta de un núcleo (metal activo) y una capa (capa protectora). La cubierta suele estar hecha de un material estable con buena resistencia a la toxicidad, como óxidos de sílice mesoporosos, materiales de carbono o alúmina. El material de la cáscara permite que los reactivos lleguen a los sitios activos del núcleo mediante el diseño de tamaños de poro y canales adecuados, al tiempo que bloquea la entrada de venenos macromoleculares. Este diseño estructural permite que el núcleo metálico activo pase sólo a través de microporos o nanocanales cuando entra en contacto con los reactivos, evitando así eficazmente que los venenos entren en contacto directo y se adsorban en la superficie metálica activa. En el caso del paladio (Pd), por ejemplo, los catalizadores en los que el núcleo de paladio está encapsulado por óxidos de silicio mesoporosos (SiO2) pueden ser significativamente más resistentes a la intoxicación. En esta estructura, el núcleo de paladio proporciona una actividad catalítica eficiente, mientras que la capa de revestimiento de SiO2 mesoporoso, a través de su selectividad de tamaño de poro, permite que los reactivos de moléculas pequeñas entren y reaccionen con el núcleo de paladio al tiempo que bloquea los venenos de moléculas grandes, evitando así eficazmente la intoxicación del núcleo de paladio.
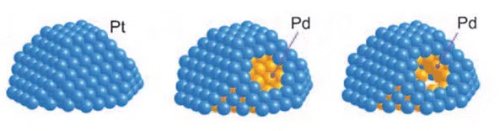
Fig. 11 Estructura del catalizador Pt-Pd Core-Shell
2. Catalizadoresmonoatómicos: Los catalizadores monoatómicos se fabrican mediante una alta dispersión de los átomos metálicos activos en la superficie del soporte, de manera que cada sitio activo es un solo átomo. Esta estructura altamente dispersa maximiza el uso de átomos metálicos y aumenta significativamente la actividad y selectividad del catalizador. Al mismo tiempo, como cada átomo metálico existe de forma independiente, es difícil que los venenos se agreguen en su superficie, lo que reduce el riesgo de envenenamiento del catalizador. Por ejemplo, los catalizadores de paladio de átomo único pueden estar muy dispersos en soportes de carbono dopados con nitrógeno. Cada átomo de paladio se estabiliza en los sitios dopados con nitrógeno a través de fuertes interacciones, y este diseño no sólo mejora la actividad catalítica, sino que también mejora significativamente la resistencia del catalizador a los venenos. Dado que es difícil que los venenos se agreguen alrededor de átomos individuales de paladio, el catalizador es significativamente más resistente a la toxicidad.
5.7 Procesos catalíticos ecológicos
Para reducir el problema de toxicidad de los catalizadores convencionales se pueden adoptar las siguientes medidas específicas. En primer lugar, utilizar disolventes respetuosos con el medio ambiente, como disolventes verdes como el agua o elCO₂supercrítico, en lugar de disolventes orgánicos tóxicos, para reducir el efecto de intoxicación de los venenos en el catalizador. Esto no solo ayuda a mejorar la seguridad de la reacción, sino que también reduce la contaminación ambiental. En segundo lugar, se desarrollan nuevos sistemas catalíticos, como la investigación y el desarrollo de tecnologías emergentes como la catálisis enzimática o la fotocatálisis. La catálisis enzimática realiza reacciones químicas ecológicas gracias a la alta selectividad y eficacia de las enzimas biológicas, mientras que la fotocatálisis utiliza la energía luminosa para impulsar el proceso de reacción y evita el problema de envenenamiento de los catalizadores tradicionales. Estos enfoques innovadores no sólo mejoran la eficiencia de la reacción, sino que también reducen el impacto negativo sobre el medio ambiente y la salud.
6 Conclusiones
Los catalizadores de metales preciosos desempeñan un papel insustituible en la industria química, la conversión de energía y la protección del medio ambiente debido a su eficaz rendimiento catalítico y a su amplia gama de aplicaciones. Sin embargo, la toxicidad de los catalizadores limita seriamente su funcionamiento estable a largo plazo y sus efectos de aplicación. Mediante un estudio en profundidad del mecanismo de los catalizadores de metales preciosos y de las causas del fenómeno de envenenamiento, podemos tomar diversas medidas para mejorar la capacidad antienvenenamiento y la vida útil de los catalizadores.
En primer lugar, la modificación del catalizador, como la aleación y la modificación de la superficie, puede mejorar significativamente el rendimiento antienvenenamiento de los catalizadores. En segundo lugar, el pretratamiento de las materias primas y la optimización de las condiciones de reacción pueden reducir eficazmente la generación y adsorción de sustancias tóxicas. Además, la regeneración del catalizador y el uso de inhibidores selectivos de tóxicos pueden ayudar a restaurar y mantener la actividad del catalizador. Los diseños avanzados de catalizadores, como los catalizadores estructurados en forma de concha y los catalizadores de un solo átomo, ofrecen nuevas vías para combatir el tóxico. Por último, la aplicación de procesos catalíticos ecológicos no sólo contribuye a reducir los problemas de toxicación, sino que también fomenta el proceso de desarrollo sostenible.
En conclusión, el rendimiento y la vida útil de los catalizadores de metales preciosos pueden mejorarse significativamente mediante la aplicación combinada de estas estrategias, satisfaciendo así la demanda de catalizadores eficientes, estables y respetuosos con el medio ambiente en la producción industrial. En el futuro, la investigación deberá seguir dedicándose al desarrollo de nuevos catalizadores antisuciedad y tecnologías catalíticas ecológicas para seguir promoviendo la amplia aplicación de los catalizadores de metales preciosos en diversos campos.
Lectura relacionada:
Aplicaciones de los catalizadores de metales preciosos: Polvo frente a pellets
Referencias:
[1] Qin T, Li N, Ma H, et al. Group VIII metals effects on lignite pyrolysis and char gasification with Ca-based catalyst[J]. Fuel,2024,372.
[2] Lysne A, Saxrud I, Snidaro L R, et al. Noble metal (Pt, Pd and Rh) promoted Ni-Co/Mg (Al)O catalysts for steam reforming of tar impurities from biomass gasification[J]. Journal of Catalysis,2024,436.
[3] Nejadmoghadam E, Achour A, Öhrman O, et al. Stabilization of fresh and aged simulated pyrolysis oil through mild hydrotreatment using noble metal catalysts[J]. Conversión y gestión de la energía,2024,313.
[4. Li L, Chen T, Zhang L, et al. Recent progress of Ni-based nanomaterials as promoter for enhancing the hydrogen evolution reaction performance of noble metal catalysts[J]. Journal of Alloys and Compounds, 2024, 998.
[5] Yun W, Rui Y, Qiang Z, et al. La-RuO2 nanocrystals with efficient electrocatalytic activity for overall water splitting in acidic media: Synergistic effect of La doping and oxygen vacancy[J]. Revista de Ingeniería Química,2022,439.

 Bares
Bares
 Cuentas y esferas
Cuentas y esferas
 Tornillos y tuercas
Tornillos y tuercas
 Crisoles
Crisoles
 Discos
Discos
 Fibras y tejidos
Fibras y tejidos
 Películas
Películas
 Escama
Escama
 Espumas
Espumas
 Folio
Folio
 Gránulos
Gránulos
 Panales
Panales
 Tinta
Tinta
 Laminado
Laminado
 Bultos
Bultos
 Mallas
Mallas
 Película metalizada
Película metalizada
 Placa
Placa
 Polvos
Polvos
 Varilla
Varilla
 Hojas
Hojas
 Cristales individuales
Cristales individuales
 Blanco para sputtering
Blanco para sputtering
 Tubos
Tubos
 Lavadora
Lavadora
 Cables
Cables
 Conversores y calculadoras
Conversores y calculadoras
 Escriba para nosotros
Escriba para nosotros
 Chin Trento
Chin Trento



