Presión de vapor: conceptos básicos y ejemplos
Qué es la presión de vapor
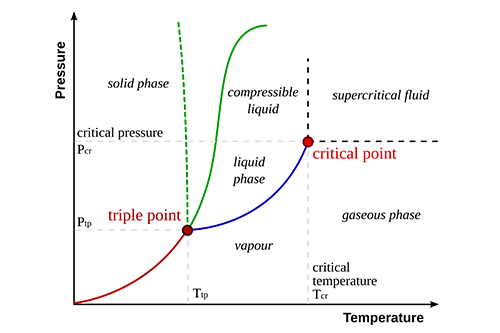
Lapresión de vapor es la presión ejercida por un vapor en equilibrio con su fase líquida o sólida a una temperatura determinada. Indica la facilidad con que una sustancia pasa de líquido a gas.
Factores que afectan a la presión de vapor
Temperatura
A medida que aumenta la temperatura, aumenta la presión de vapor porque más moléculas tienen energía para escapar de la fase líquida.
Fuerzas intermoleculares
A mayores fuerzas intermoleculares, menor presión de vapor, ya que las moléculas necesitan más energía para vaporizarse.
Naturaleza de la sustancia
Las distintas sustancias tienen presiones de vapor diferentes en función de su estructura molecular y sus enlaces.
Medición de la presión de vapor
- Método manométrico: Se utiliza un recipiente sellado con un líquido, y la presión de vapor se mide utilizando un manómetro después de que el sistema alcanza el equilibrio.
- Método dinámico: Los cambios en el volumen o peso del líquido se controlan a lo largo del tiempo para calcular la presión de vapor.
- Método de efusión: Mide la velocidad a la que las moléculas de gas escapan a través de un pequeño orificio, lo que ayuda a calcular la presión de vapor.
- Ecuación de Clausius-Clapeyron: Se utiliza para calcular la presión de vapor a diferentes temperaturas.
Importancia de la medición de la presión de vapor
La medición de la presión de vapor es esencial en diversos campos, entre ellos:
- Predicción meteorológica: La presión de vapor se utiliza para determinar la humedad y predecir patrones meteorológicos.
- Procesos industriales: Ayuda en la destilación, evaporación y otros procesos que implican transiciones de fase.
- Ingeniería química: Interviene en el diseño de equipos como intercambiadores de calor, reactores y evaporadores.
- Industria farmacéutica: las mediciones de la presión de vapor son importantes para la estabilidad y el almacenamiento de compuestos volátiles.
Ejemplos de presión de vapor
Agua
A 25°C, el agua tiene una presión de vapor de aproximadamente 23,8 mmHg, lo que indica una volatilidad moderada.
Acetona
La acetona presenta una presión de vapor superior a la del agua a la misma temperatura, lo que la hace más volátil.
Mercurio
El mercurio tiene una presión de vapor muy baja, lo que refleja sus fuertes enlaces metálicos y su baja tendencia a vaporizarse.
Tabla de presión de vapor
Aquí tienes una tabla con los valores de presión de vapor de varias sustancias a diferentes temperaturas. La presión de vapor se refiere a la presión ejercida por el vapor cuando está en equilibrio con su fase líquida (o sólida) a una temperatura determinada.
|
Sustancia |
Presión de vapor a 20°C (mmHg) |
Presión de vapor a 100°C (mmHg) |
|
Agua |
17.5 |
760 |
|
Etanol |
44.6 |
400 |
|
Acetona |
180 |
760 |
|
Metanol |
95.3 |
1300 |
|
Benceno |
75.1 |
450 |
|
Éter dietílico |
430 |
5800 |
|
Mercurio |
0.0012 |
0.2 |
|
Hexano |
150 |
450 |
|
Tolueno |
22.3 |
230 |
|
Cloroformo |
160 |
500 |
Para más información, consulteStanford Advanced Materials (SAM).
Preguntas más frecuentes
¿Qué es la presión de vapor?
La presión de vapor es la presión ejercida por un vapor cuando está en equilibrio con su forma líquida o sólida.
¿Cómo afecta la temperatura a la presión de vapor?
El aumento de la temperatura suele incrementar la presión de vapor, ya que más moléculas adquieren la energía necesaria para vaporizarse.
¿Por qué la presión de vapor del agua es menor que la de la acetona?
El agua tiene enlaces de hidrógeno más fuertes, por lo que necesita más energía para vaporizarse que la acetona.
¿Puede la presión de vapor predecir la volatilidad de una sustancia?
Sí, una presión de vapor más alta indica una mayor volatilidad y una mayor tendencia a vaporizarse.
¿Qué importancia tiene la presión de vapor en la predicción meteorológica?
La presión de vapor contribuye a los niveles de humedad, lo que influye en los patrones meteorológicos y las precipitaciones.